Sadržaj
- Kročiti
- Dio 1 od 2: Dodjela oksidacijskih brojeva na temelju kemijskih pravila
- Dio 2 od 2: Dodjeljivanje brojeva atomima bez pravila za oksidacijske brojeve
- Savjeti
- Potrebe
U kemiji izrazi "oksidacija" i "redukcija" znače one reakcije u kojima atom (ili skupina atoma) gubi ili dobiva elektrone. Oksidacijski brojevi brojevi su dodijeljeni atomima (ili skupinama atoma) kako bi pomogli kemičarima u kontroli koliko elektrona je dostupno za istiskivanje i oksidiraju li ili reaktiviraju reaktanti tijekom reakcije. Proces dodjeljivanja oksidacijskih brojeva atomima može se kretati od vrlo jednostavnih do složenijih, ovisno o naboju atoma i kemijskom sastavu molekula čiji su dio. Da stvar bude složenija, neki atomi mogu imati više oksidacijskih brojeva. Srećom, dodjelom oksidacijskih brojeva upravljaju jasno definirana pravila koja se lako slijede, ali osnovno razumijevanje kemije i algebre znatno će olakšati upotrebu ovih pravila.
Kročiti
Dio 1 od 2: Dodjela oksidacijskih brojeva na temelju kemijskih pravila
 Utvrdite je li predmetna tvar elementarna. Slobodni, nevezani atomi uvijek imaju oksidacijski broj 0. To vrijedi i za atome koji se sastoje od jednog atoma i za atome čiji je elementarni oblik dvoatomski ili polatomski.
Utvrdite je li predmetna tvar elementarna. Slobodni, nevezani atomi uvijek imaju oksidacijski broj 0. To vrijedi i za atome koji se sastoje od jednog atoma i za atome čiji je elementarni oblik dvoatomski ili polatomski. - Na primjer, Al(s) i Cl2 oba imaju oksidacijski broj 0, jer nisu složeni atomi.
- Imajte na umu da sumpor u svom elementarnom obliku, S.8 (oktasumpor), iako nepravilan, također ima oksidacijski broj 0.
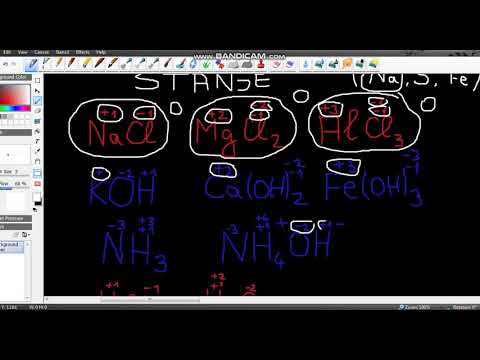
 Utvrdite je li dotična tvar ion. Joni imaju oksidacijske brojeve jednake naboju. To vrijedi za nevezane ione, kao i za ione koji su dio složenog iona.
Utvrdite je li dotična tvar ion. Joni imaju oksidacijske brojeve jednake naboju. To vrijedi za nevezane ione, kao i za ione koji su dio složenog iona. - Na primjer, ion Cl ima oksidacijski broj -1.
- Cl ion još uvijek ima oksidacijski broj -1 kad je dio spoja NaCl. Budući da Na ion po definiciji ima naboj od +1, znamo da ion Cl ima naboj od -1, tako da je oksidacijski broj još uvijek -1.
 U slučaju metalnih iona, dobro je zapamtiti da su mogući višestruki oksidacijski brojevi. Mnogi metali mogu imati više od jednog slijetanja. Na primjer, metalno željezo (Fe) može biti ion s nabojem +2 ili +3. naboj metalnih iona (a time i njihovi oksidacijski brojevi) može se odrediti u odnosu na naboj ostalih atoma u čijem su sastavu ili, kada su napisani kao tekst, zapisom rimskim brojevima (kao npr. u rečenica: "Željezni (III) ion ima naboj +3.").
U slučaju metalnih iona, dobro je zapamtiti da su mogući višestruki oksidacijski brojevi. Mnogi metali mogu imati više od jednog slijetanja. Na primjer, metalno željezo (Fe) može biti ion s nabojem +2 ili +3. naboj metalnih iona (a time i njihovi oksidacijski brojevi) može se odrediti u odnosu na naboj ostalih atoma u čijem su sastavu ili, kada su napisani kao tekst, zapisom rimskim brojevima (kao npr. u rečenica: "Željezni (III) ion ima naboj +3."). - Na primjer, pogledajmo izbliza spoj koji sadrži ion aluminija. Spoj AlCl3 ima naboj od 0. Budući da znamo da ioni Cl imaju naboj od -1, a u spoju su prisutna 3 iona Cl, ion Al-ion mora imati naboj od +3, tako da naboj svih zbrojenih iona iznosi 0. Dakle, oksidacijski broj Al je +3.
 Dodijelite oksidacijski broj -2 kisiku (uz iznimke). U skoro u svim slučajevima atomi kisika imaju oksidacijski broj -2. Postoji nekoliko iznimaka od ovog pravila:
Dodijelite oksidacijski broj -2 kisiku (uz iznimke). U skoro u svim slučajevima atomi kisika imaju oksidacijski broj -2. Postoji nekoliko iznimaka od ovog pravila: - Kad je kisik u elementarnom stanju (O2), tada je oksidacijski broj jednak 0, što je slučaj za sve elementarne atome.
- Kada je kisik dio peroksid, tada je oksidacijski broj -1. Peroksidi su klasa spojeva koji imaju vezu kisik-kisik (ili peroksid anion O2). Na primjer, u molekuli H2O2 (vodikov peroksid), kisik ima oksidacijski broj (i naboj) -1. Također, kada je kisik dio superoksida, oksidacijski broj je -0,5.
- Kad je kisik vezan za fluor, oksidacijski broj je +2. Pogledajte pravilo fluora u nastavku za više informacija. U (O2F.2) ovo je +1.
 Dodijelite oksidacijski broj +1 vodiku (uz iznimke). Kao i kod kisika, oksidacijski broj vodika ovisi o iznimnim slučajevima. Općenito, vodik ima oksidacijski broj +1 (osim u elementarnom obliku, H.2). Ali u slučaju posebnog spoja zvanog hibridi, vodik ima oksidacijski broj -1.
Dodijelite oksidacijski broj +1 vodiku (uz iznimke). Kao i kod kisika, oksidacijski broj vodika ovisi o iznimnim slučajevima. Općenito, vodik ima oksidacijski broj +1 (osim u elementarnom obliku, H.2). Ali u slučaju posebnog spoja zvanog hibridi, vodik ima oksidacijski broj -1. - Primjerice, iz H2Oh, znamo da vodik ima oksidacijski broj +1, jer kisik ima naboj -2, a trebaju nam 2 +1 naboja da bismo napravili spoj s ukupnim nabojem nula. Ali s tvari natrijev hidrid, NaH, vodik ima oksidacijski broj -1, jer ion Na ima naboj +1, a da bi ukupni naboj spoja 0 bio, vodik ima naboj (a time i oksidacijski broj) -1.
 Fluor stalno oksidacijski broj -1. Kao što je gore navedeno, oksidacijski brojevi određenih elemenata mogu varirati zbog različitih čimbenika (metalni ioni, atomi kisika u peroksidima, itd.). S druge strane, fluor ima oksidacijski broj -1, a to se nikad ne mijenja. To je zato što je fluor najizrazitiviji elektro-negativni element, ili drugim riječima, to je element koji se najmanje želi odreći elektrona i najvjerojatnije preuzima elektrone od drugih atoma. Stoga se oksidacijski broj neće mijenjati.
Fluor stalno oksidacijski broj -1. Kao što je gore navedeno, oksidacijski brojevi određenih elemenata mogu varirati zbog različitih čimbenika (metalni ioni, atomi kisika u peroksidima, itd.). S druge strane, fluor ima oksidacijski broj -1, a to se nikad ne mijenja. To je zato što je fluor najizrazitiviji elektro-negativni element, ili drugim riječima, to je element koji se najmanje želi odreći elektrona i najvjerojatnije preuzima elektrone od drugih atoma. Stoga se oksidacijski broj neće mijenjati.  Oksidacijski brojevi u spoju jednaki su naboju spoja. Oksidacijski brojevi svih atoma u spoju jednaki su naboju tog spoja. Na primjer, ako spoj nema naboj, tada će zbroj svih oksidacijskih brojeva biti nula; ako je spoj polikatni ion s nabojem od -1, dodani oksidacijski brojevi moraju biti -1, itd.
Oksidacijski brojevi u spoju jednaki su naboju spoja. Oksidacijski brojevi svih atoma u spoju jednaki su naboju tog spoja. Na primjer, ako spoj nema naboj, tada će zbroj svih oksidacijskih brojeva biti nula; ako je spoj polikatni ion s nabojem od -1, dodani oksidacijski brojevi moraju biti -1, itd. - Ovo je dobar način da provjerite svoj odgovor - ako zbrojeni oksidacijski brojevi spoja nisu jednaki naboju tog spoja, tada znate da ste pogriješili.
Dio 2 od 2: Dodjeljivanje brojeva atomima bez pravila za oksidacijske brojeve
 Pronađite atome bez pravila oksidacijskog broja. Neki atomi ne slijede pravila za pronalaženje oksidacijskih brojeva. Ako atom nije u skladu s gornjim pravilima i niste sigurni koliki mu je naboj (na primjer, ako je dio većeg spoja tako da je pojedinačni naboj nepoznat), oksidacijski broj tog atoma možete pronaći pomoću eliminacija. Prvo odredite kolika je oksidacija svakog drugog atoma u spoju. Tada u jednadžbi rješavate zbroj nepoznatog na temelju ukupnog naboja spoja.
Pronađite atome bez pravila oksidacijskog broja. Neki atomi ne slijede pravila za pronalaženje oksidacijskih brojeva. Ako atom nije u skladu s gornjim pravilima i niste sigurni koliki mu je naboj (na primjer, ako je dio većeg spoja tako da je pojedinačni naboj nepoznat), oksidacijski broj tog atoma možete pronaći pomoću eliminacija. Prvo odredite kolika je oksidacija svakog drugog atoma u spoju. Tada u jednadžbi rješavate zbroj nepoznatog na temelju ukupnog naboja spoja. - Na primjer, u spoju Na2TAKO4, naboj sumpora (S) je nepoznat - nije u svom elementarnom obliku, dakle nije 0, ali to je sve što znamo. Ovo je dobar kandidat za primjenu ove metode za algebarsko određivanje oksidacijskog broja.
 Odredite poznate oksidacijske brojeve ostalih elemenata u spoju. Koristeći pravila dodjele oksidacijskog broja, određujemo koje oksidacijske brojeve imaju ostali atomi u spoju. Budite svjesni iznimki poput O, H itd.
Odredite poznate oksidacijske brojeve ostalih elemenata u spoju. Koristeći pravila dodjele oksidacijskog broja, određujemo koje oksidacijske brojeve imaju ostali atomi u spoju. Budite svjesni iznimki poput O, H itd. - U Na2TAKO4, na temelju našeg skupa pravila znamo da ion Na ima naboj (a time i oksidacijski broj) +1 i da atomi kisika imaju oksidacijski broj -2.
 Pomnožite broj svakog atoma s oksidacijskim brojem. Sad kad znamo oksidacijske brojeve svih atoma, osim nepoznatih, morat ćemo uzeti u obzir da se neki od tih atoma mogu pojaviti više puta. Pomnožite svaki koeficijent (zapisan u indeksu nakon simbola atoma u spoju) s oksidacijskim brojem.
Pomnožite broj svakog atoma s oksidacijskim brojem. Sad kad znamo oksidacijske brojeve svih atoma, osim nepoznatih, morat ćemo uzeti u obzir da se neki od tih atoma mogu pojaviti više puta. Pomnožite svaki koeficijent (zapisan u indeksu nakon simbola atoma u spoju) s oksidacijskim brojem. - Što se tiče Na2TAKO4, znamo da postoje 2 atoma Na i 4 O atoma. Sada radimo sljedeći izračun, 2 × +1, da bismo dobili oksidacijski broj Na, 2, i pomnožimo 4 × -2, oksidacijski broj O, -8.
 Zbrojite rezultate. Zbrajanjem rezultata ovih množenja dobiva se oksidacijski broj spoja, bez uzimajući u obzir oksidacijski broj nepoznatog atoma.
Zbrojite rezultate. Zbrajanjem rezultata ovih množenja dobiva se oksidacijski broj spoja, bez uzimajući u obzir oksidacijski broj nepoznatog atoma. - U našem primjeru s Na2TAKO4, zbrojimo 2 na -8 da bismo dobili -6.
 Izračunajte nepoznati oksidacijski broj na temelju naboja spoja. Sada imate sve podatke kako pronaći nepoznati oksidacijski broj pomoću neke jednostavne algebre. Upotrijebit ćemo jednadžbu i odgovor iz prethodnog koraka, plus naboj spoja. Drugim riječima: (Zbroj nepoznatih oksidacijskih brojeva) + (nepoznati oksidacijski broj koji želite znati) = (naboj spoja).
Izračunajte nepoznati oksidacijski broj na temelju naboja spoja. Sada imate sve podatke kako pronaći nepoznati oksidacijski broj pomoću neke jednostavne algebre. Upotrijebit ćemo jednadžbu i odgovor iz prethodnog koraka, plus naboj spoja. Drugim riječima: (Zbroj nepoznatih oksidacijskih brojeva) + (nepoznati oksidacijski broj koji želite znati) = (naboj spoja).- U primjeru Na2TAKO4, rješavamo ovo na sljedeći način:
- (Zbroj poznatih oksidacijskih brojeva) + (nepoznati oksidacijski broj koji želite riješiti) = (naboj spoja)
- -6 + S = 0
- S = 0 + 6
- S = 6. S ima oksidacijski broj ili 6 u Na2TAKO4.
- U primjeru Na2TAKO4, rješavamo ovo na sljedeći način:
Savjeti
- Atomi u svom osnovnom obliku uvijek imaju oksidacijski broj 0. Ion koji se sastoji od 1 atoma ima oksidacijski broj jednak naboju. Metali skupine 1A poput vodika, litija i natrija imaju oksidacijski broj +1; Metali skupine 2A, poput magnezija i kalcija, imaju oksidacijski broj od +2. I vodik i kisik mogu imati 2 različita oksidacijska broja, ovisno o njihovoj vezi.
- U spoju zbroj svih oksidacijskih brojeva treba biti jednak 0. Ako postoji ion s 2 atoma, tada bi zbroj oksidacijskih brojeva trebao biti jednak naboju iona.
- Vrlo je korisno znati čitati periodni sustav i gdje pronaći metale i nemetale.
Potrebe
- Periodni sustav elemenata
- Internet veza
- Knjiga o kemiji
- Papir, olovka ili olovka
- Kalkulator