Autor:
Louise Ward
Datum Stvaranja:
11 Veljača 2021
Datum Ažuriranja:
1 Srpanj 2024

Sadržaj
Veličina atoma je toliko mala da je teško točno izmjeriti atomski broj kemijskog spoja. Da bi mogli točno izmjeriti količinu tvari, znanstvenici koriste jedinicu mola za predstavljanje određenog broja atoma. Jedan mol supstance definiran je kao ekvivalentan broju atoma ugljika sadržanom u 12 grama izotopa 12 ugljika, što je oko 6.022 x 10 atoma. Ta se vrijednost naziva Avogadrov broj ili Avogadrova konstanta. To se također naziva brojem atoma u 1 molu bilo kojeg elementa, a 1 mol mase tvari naziva se molarna masa te tvari.
Koraci
Metoda 1 od 2: Izračunajte molarnu masu elementa
Definicija molarne mase. Molarna masa tvari je masa (u gramima) jednog mola te tvari. Da biste izračunali molarnu masu elementa, pomnožite njegovu atomsku masu s konverzijskim faktorom gram-po-mol (g / mol).
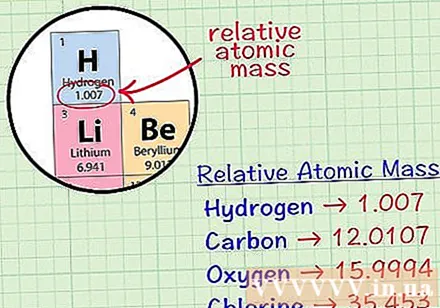
Pronađite prosječni kubni atom elementa. Prosječna masa atoma elementa je prosječna masa, u atomskim jedinicama, u uzorku koji uključuje sve izotope tog elementa. Ti se podaci obično daju na periodnom sustavu elemenata. Lociranjem elementa možete pronaći prosječni kubni atom napisan odmah ispod kemijskog simbola elementa. Ova vrijednost nije cijeli broj, već broj s decimalama.- Na primjer, s vodikom je prosječna masa atoma 1,007; Prosječni kubni atom ugljika je 12.0107; Prosječna masa atoma kisika je 15.9994; klor ima prosječnu atomsku masu od 35.453.

Pomnožite atom prosječne mase s konstantom molarne mase. Jedinica rastaljene mase definirana je kao 0,001 kilogram po molu ili 1 gram po molu. Umnožak atoma srednje mase i konstante molarne mase pretvara jedinicu atomske mase u grame po molu, pa će molarna masa vodika biti 1,007 grama po molu, za ugljik je 12. , 0107 grama po molu, kisika je 15,9995 grama po molu, a klor 35,453 grama po molu.- Neki elementi postoje u prirodi kao molekule koje se sastoje od dva ili više istih atoma. Odnosno, ako želite izračunati molarnu masu spojeva sastavljenih od više od jednog atoma, kao što su plinoviti vodik, plinoviti kisik ili plinoviti klor, morate odrediti prosječnu atomsku masu spoja i pomnožiti tu vrijednost. s konstantom molarne mase, '' zatim '' pomnožite proizvod koji ste upravo pronašli sa 2.
- Sa H2: 1.007 x 2 = 2.014 grama po molu; za O2: 15,9994 x 2 = 31,9988 grama po molu; i Cl2: 35.453 x 2 = 70.096 grama po molu.
Metoda 2 od 2: Izračunajte molarnu masu spoja

Odrediti strukturnu formulu spoja. Strukturna formula tvari daje atomski broj svakog elementa koji čini taj spoj. (Ovi su podaci dostupni u svim referentnim knjigama). Na primjer, kemijska formula solne kiseline je HCl; glukoze je C6H12O6. Pomoću ove strukturne formule možemo odrediti broj svake vrste atoma koji čine spoj koji se razmatra.- Gdje HCl ima jedan atom vodika i jedan atom klora.
- Molekula šećera glukoze C6H12O6 ima 6 atoma ugljika, 12 atoma vodika i 6 atoma kisika.
Odredite prosječnu masu atoma svakog sastavnog elementa. Pomoću periodnog sustava pronađite prosječnu masu atoma svakog elementa prisutnog u spoju. Prosječni maseni atom obično je zapisan ispod kemijskog simbola elementa na periodnom sustavu. Slično izračunavanju molarne mase elementa, pomnožite atom prosječne mase s 1 gram / mol.
- Prosječna masa atoma elemenata koji čine solnu kiselinu je kako slijedi: vodik 1.007 g / mol i klor 35.453 g / mol.
- Prosječna masa atoma elemenata koji čine molekulu glukoze je: ugljik, 12.017 g / mol; vodik, 1.007 g / mol; i kisik, 15,9995 g / mol.
Izračunajte molarnu masu svakog sastavnog elementa. Množenjem atoma mase elementa s brojem atoma kojima on doprinosi u spoju dobiva se prosječna masa elementa u spoju.
- U slučaju klorovodične kiseline, klorovodične kiseline, molarna masa elementa vodik je 1.007 g / mol, a klora 35.453 g / mol.
- U slučaju glukoze, C6H12O6, molarna masa svakog elementa je sljedeća: ugljik, 12,0107 x 6 = 72,0642 g / mol; vodik, 1.007 x 12 = 12.084 g / mol; kisik, 15.9995 x 6 = 95.9964 g / mol.
Zbroj molarnih masa sastavnih elemenata. Ukupna molarna masa elemenata za kompostiranje je molarna masa spoja.U prethodnom smo koraku izračunali molarnu masu svakog elementa prisutnog u spoju, u ovom koraku samo trebamo sabrati sve ove vrijednosti.
- Molarna masa solne kiseline je 1.007 + 35.453 = 36.460 g / mol. 36,46 grama je masa 1 mola solne kiseline.
- Molarna masa glukoze je 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Dakle, svaki mol glukoze ima masu od 180,14 grama.
Savjet
- Iako se u većini slučajeva prosječna masa atoma bilježi na najbliži 1 dio 1000 (4 decimale), u laboratorijima se molarna masa često smanjuje na 2 decimale, ponekad i manje, za velike molekule. Stoga se u laboratorijskom slučaju molarna masa klorovodične kiseline može zapisati kao 36,46 g po molu, a za glukozu 180,14 g po molu.
Što trebaš
- Kemijski priručnik ili periodni sustav elemenata
- Računalo