Autor:
Lewis Jackson
Datum Stvaranja:
6 Svibanj 2021
Datum Ažuriranja:
1 Srpanj 2024
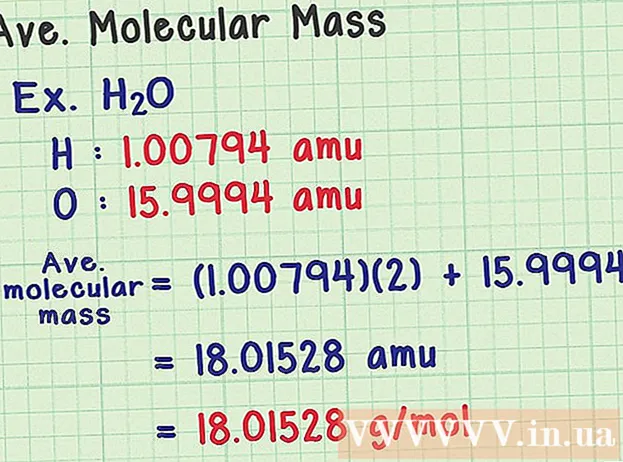
Sadržaj
Prosječna masa atoma nije izravna mjera mase atoma. Umjesto toga, ovo je prosječna masa po atomu iz tipičnog uzorka elementa. Ako možete izmjeriti mase milijardi pojedinih atoma, to možete saznati izračunavanjem njihovog prosjeka. Imamo praktičniju metodu koja se temelji na informacijama o različitim izotopima kemijskog elementa.
Koraci
Dio 1 od 2: Izračunajte prosječnu masu atoma
Razumjeti izotope i atome mase. U prirodi većina elemenata postoji u mnogim oblicima ili izotopima. Jedina razlika između dva izotopa istog elementa je broj neutrona u atomu, čiji broj neutrona utječe na maseni atom. Izračun prosječne masenog atoma uzima u obzir učinak ove razlike i govori vam prosječnu masu svakog atoma u uzorku tih atoma.
- Na primjer, element srebro (Ag) ima dva prirodna izotopa: Ag-107 i Ag-109 (ili Ag i Ag). Izotop je dobio ime po "masenom broju", odnosno zbroju broja protona i broja neutrona u atomu. To znači da Ag-109 ima dva neutrona više od Ag-107, pa je njegov atom malo teži.

Pronađite masu svakog izotopa. Za svaki izotop potrebna su vam dva podatka. Možete ih potražiti u referentnim knjigama ili na mreži, na primjer webelements.com. Prva je maseni atom ili atomska masa svakog izotopa. Izotopi s više neutrona imaju veću masu.- Na primjer, izotop srebra Ag-107 ima maseni atom 106,90509 amu (jedinica kubičnog atoma). Izotop Ag-109 je nešto teži s masom od 108,90470.
- Par decimala na kraju može se malo razlikovati u dokumentima. Ne zapiši brojeve u zagrade nakon mise.

Zapišite prirodnu stopu preživljavanja za svaki izotop. Ovaj omjer ukazuje na prevalenciju izotopa, kao postotak ukupnih atoma elementa. Te podatke možete pronaći u istom dokumentu na kojem je kubni atom. Prirodno preživljavanje svih izotopa trebalo bi biti 100% (iako se može malo razlikovati zbog pogreške zaokruživanja).- Izotop Ag-107 ima omjer 51,86%. Izotop Ag-109 rjeđi je po stopi od 48,14%. To znači da normalni uzorak srebra ima 51,86% Ag-107 i 48,14% Ag-109.
- Izotopi koji nemaju ovu stopu preživljavanja se zanemaruju. Ti izotopi ne postoje prirodno na zemlji.

Pretvorite postotak izotopa u decimalni broj. Podijelite li ovaj omjer sa 100, dobit će se ista vrijednost kao decimalna vrijednost.- U gornjem uzorku srebra, omjer izotopa je 51,86 / 100 = 0,5186 i 48,14 / 100 = 0,4814.
Pronađite prosječni kubni atom. Prosječna masa atoma elementa ima n izotopi jednaki (Atomski blokIzotop 1 * omjerIzotop 1) + (atomska masaIzotop 2 * omjerIzotop 2) + ... + (atomska masaizotopi n * omjerizotopi n. Ovo je primjer "prosječne mase", što znači da što je veća stopa preživljavanja izotopa, to je veći njegov učinak na rezultat. Kako primijeniti ovu formulu za srebro je kako slijedi:
- Atom srednje maseAg = (maseni atomAg-107 * omjerAg-107) + (atomska masaAg-109 * omjerAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Pronađite taj element na periodnom sustavu kako biste provjerili rezultate. Prosječni kubni atom uvijek je zapisan ispod kemijskog simbola elementa.
- Atom srednje maseAg = (maseni atomAg-107 * omjerAg-107) + (atomska masaAg-109 * omjerAg-109)
Dio 2 od 2: Korištenje rezultata
Pretvori masu u atomski broj. Prosječni maseni atom pokazuje odnos između mase i broja atoma u tipičnom uzorku tog elementa. To je vrlo korisno u kemijskim laboratorijima, jer je gotovo nemoguće točno izračunati atome, ali mase je lako odrediti. Na primjer, mogli biste izvagati uzorak srebra i znati da će na svakih 107.8677 amu biti jedan atom srebra.
Pretvori u molarnu masu. Jedinica atomske mase vrlo je mala, pa kemičari često koriste gramsku jedinicu za masu. Srećom imamo definicije tih pojmova pa bi transformacija trebala biti laka. Dovoljno je pomnožiti prosječni maseni atom s 1 g / mol (konstanta molarne mase) da biste dobili rezultat u g / mol. Primjerice, 107.8677 grama srebra sadrži jedan mol atoma srebra.
Pronađite prosječnu molekularnu masu. Budući da je molekula skup atoma, možete dodati masu svih atoma kako biste pronašli molekularnu masu. Ako biste koristili atom prosječne mase (umjesto mase određenog izotopa), rezultat bi bio prosječna molekularna masa uzorka u prirodi. Evo primjera:
- Molekula vode ima kemijsku formulu H2O sadrži dva atoma vodika (H) i jedan atom kisika (O).
- Vodik ima prosječnu masu atoma od 1.00794 amu. Kisik ima prosječnu atomsku masu od 15.9994 amu.
- Dakle, prosječna molekulska masa H2O je jednako (1,00794) (2) + 15,9994 = 18,01528 amu, što je ekvivalentno 18,01528 g / mol.
Savjet
- Pojam relativne atomske mase ponekad se koristi sinonim za prosječni atom mase. Mala je razlika jer je atomska masa relativno un jedinica; to je mjerenje mase u odnosu na atom ugljika-12. Sve dok koristite jedinicu atomske mase u izračunu prosječnog kubnog atoma, ove dvije vrijednosti su iste.
- Broj u zagradama nakon kubnog atoma govori nam o pogrešci. Na primjer, maseni atom 1,0173 (4) znači da normalni atom elementa ima raspon mase od oko 1,0173 ± 0,0004. Ne morate dobiti ovaj broj ako nije zatražen.
- Na periodnom sustavu prosječni kubni atom sljedećeg elementa bit će veći od onog prije njega, uz rijetke iznimke. Evo brzog načina za provjeru rezultata.
- 1 jedinica atomske mase jednaka je 1/12 mase atoma ugljika-12.
- Stope preživljavanja izotopa izračunavaju se prema tipičnim uzorcima koji se prirodno javljaju na zemlji. Tvari koje se ne pojavljuju u prirodi, poput meteorita ili one proizvedene u laboratoriju, mogu imati različite omjere izotopa, pa je i prosječna masa atoma različita.
Upozorenje
- Atomi mase uvijek se zapisuju u atomskim jedinicama mase (amu ili u), ponekad zvanim daltonima (Da). Nikada nemojte nakon ovog broja upisati drugu jedinicu mase (poput kilograma), a da je ne promijenite.
Što trebaš
- Olovka
- Papir
- Laptop
- Podaci o stopi preživljavanja izotopa u prirodi.
- Podaci o atomskim jedinicama mase za izotope.