Autor:
Lewis Jackson
Datum Stvaranja:
5 Svibanj 2021
Datum Ažuriranja:
1 Srpanj 2024

Sadržaj
Mol je standardna mjerna jedinica u kemiji, koja se koristi za promatranje različitih elemenata u spoju. Obično se masa spoja izračunava u gramima (g) i treba ga pretvoriti u molarne jedinice. Prijelaz je prilično jednostavan, međutim, još uvijek postoje neki važni koraci koje moramo slijediti. Pomoću donje metode možete lako pretvoriti grame u molove.
Koraci
Dio 1 od 2: Izračunavanje molekularne mase
Pripremite potrebne zalihe za rješavanje matematičkog problema. Kad imate na raspolaganju sve alate, bit će lakše riješiti problem. Ono što trebate je:
- Olovka i papir. Matematika postaje lakša kad sve zapišete na papir. Morate predstaviti sve korake kako biste postigli maksimalan rezultat.
- Periodni sustav kemijskih elemenata: koristi se za određivanje masenih atoma elemenata.
- Džepni kalkulator: koristi se za izračunavanje složenih brojeva.

Odredite koji se elementi nalaze u spoju koji trebate pretvoriti u molarne jedinice. Prvi korak u izračunavanju molekularne mase je određivanje elemenata koji čine spoj. To je lako jer je kratica elemenata samo jedan do dva znaka.- Ako je tvar skraćena s dva slova, prvo slovo bit će napisano velikim, a drugo slovo malim slovima. Primjer: Mg je kratica za element magnezij.
- NaHCO spojevi3 sastoji se od četiri elementa: natrij (Na), vodik (H), ugljik (C) i kisik (O).
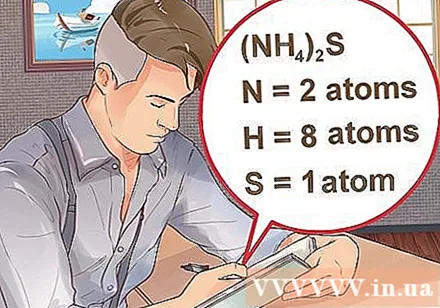
Odredite broj atoma za svaki element u spoju. Morate znati atomski broj svake tvari u spoju da biste izračunali molekulu mase tog spoja. Mali broj uz kraticu elementa predstavlja atomski broj elementa.- Primjer: spoj H2O ima dva atoma vodika i jedan atom kisika.
- Ako je spoj napisan u zagradama, popraćen malim indeksom, to znači da svaki sastojak u zagradama množi indeks. Primjer: spoj (NH4)2S se sastoji od dva N atoma, osam atoma H i jednog S atoma.

Zapišite kubni atomski papir za svaki element. Korištenje periodnog sustava najlakši je način pronalaska kubnog atoma elementa. Nakon što locirate element na periodnom sustavu, vidjet ćete atomsku masu odmah ispod ikone elementa.- Na primjer, kubni atom kisika je 15,99.
Izračunajte molekulsku masu. Molekula mase tvari jednaka je broju atoma svakog elementa pomnoženom s masnim atomom tog elementa. Ova je količina bitna u konverziji grama u molar.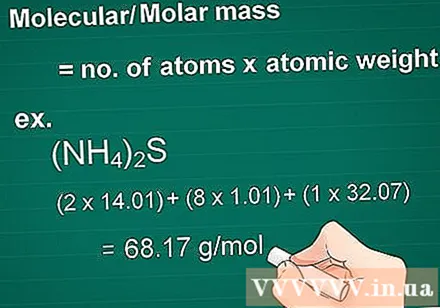
- Prvo pomnožite atomski broj svakog elementa u spoju s njegovim masnim atomom.
- Zatim zajedno dodajte mase elemenata u spoju.
- Primjer: Molekularna masa spoja (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekularna masa je također poznata i kao molarna masa.
Dio 2 od 2: Pretvorite grame u mol
Postavite formulu pretvorbe. Da biste pronašli broj molova spoja, podijelite broj grama spoja s molarnom masom tog spoja.
- Formula: broj mola = masa (grami) / molarna masa spoja (gram / mol)
Zamijenite brojeve u formulu. Nakon postavljanja prave formule, sljedeći je korak zamjena brojeva koje ste izračunali u formulu. Ako želite biti sigurni da su podaci u ispravnom položaju, možete ih provjeriti potiskivanjem jedinice. Ako su nakon jednostavnosti preostala jedinica madeži, tada ste pravilno postavljeni.
Riješi jednadžbu. Pomoću kalkulatora podijelite masu s kubnom molekulom tvari ili spoja. Kvocijent će biti broj molova supstance ili spoja koji tražite.
- Primjerice, problem je za 2 g vode (H2O) i tražimo da ga pretvorite u molarne jedinice. Imamo molarnu masu H2O je 18g / mol. Podijelite 2 sa 18, tako da imate 0,1111 mol H2O.
Savjet
- Ne zaboravite uz odgovore navesti i naziv elementa ili složenice.
- Ako se od vas zatraži da predstavite vježbu ili kviz, svakako odgovor jasno pokažite kruženjem ili crtanjem okvira oko odgovora.
Što trebaš
- Kemijski periodni sustav
- Olovka
- Papir
- Računalo
- Problemi s kemijom