Autor:
Sara Rhodes
Datum Stvaranja:
12 Veljača 2021
Datum Ažuriranja:
1 Srpanj 2024
Sadržaj
- Koraci
- Dio 1 od 2: Određivanje oksidacijskog stanja prema kemijskim zakonima
- Dio 2 od 2: Određivanje oksidacijskog stanja bez uporabe zakona kemije
- Savjeti
- Što trebaš
U kemiji izrazi "oksidacija" i "redukcija" označavaju reakcije u kojima atom ili skupina atoma gube ili dobivaju elektrone. Oksidacijsko stanje je numerička vrijednost dodijeljena jednom ili više atoma koja karakterizira broj preraspodijeljenih elektrona i pokazuje kako su ti elektroni raspoređeni među atomima tijekom reakcije. Određivanje ove vrijednosti može biti jednostavan i prilično složen postupak, ovisno o atomima i molekulama koje se sastoje od njih. Štoviše, atomi nekih elemenata mogu imati nekoliko oksidacijskih stanja. Srećom, postoje jednostavna nedvosmislena pravila za određivanje oksidacijskog stanja, za čiju je sigurnu uporabu dovoljno poznavati osnove kemije i algebre.
Koraci
Dio 1 od 2: Određivanje oksidacijskog stanja prema kemijskim zakonima
 1 Utvrdite je li dotična tvar elementarna. Oksidacijsko stanje atoma izvan kemijskog spoja je nula. Ovo pravilo vrijedi i za tvari nastale od zasebnih slobodnih atoma, i za one koje se sastoje od dvije ili višeatomske molekule jednog elementa.
1 Utvrdite je li dotična tvar elementarna. Oksidacijsko stanje atoma izvan kemijskog spoja je nula. Ovo pravilo vrijedi i za tvari nastale od zasebnih slobodnih atoma, i za one koje se sastoje od dvije ili višeatomske molekule jednog elementa. - Na primjer, Al(s) i Cl2 imaju oksidacijsko stanje 0, budući da su oba u kemijski nevezanom elementarnom stanju.
- Imajte na umu da alotropni oblik sumpora S8, ili oktacera, unatoč atipičnoj strukturi, također karakterizira nulto oksidacijsko stanje.
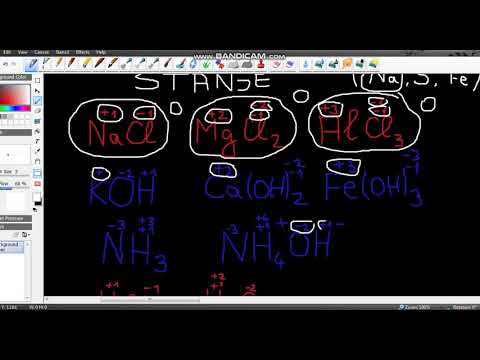
 2 Utvrdite je li dotična tvar sastavljena od iona. Oksidacijsko stanje iona jednako je njihovom naboju. To vrijedi i za slobodne ione i za one koji su dio kemijskih spojeva.
2 Utvrdite je li dotična tvar sastavljena od iona. Oksidacijsko stanje iona jednako je njihovom naboju. To vrijedi i za slobodne ione i za one koji su dio kemijskih spojeva. - Na primjer, oksidacijsko stanje iona Cl je -1.
- Oksidacijsko stanje iona Cl u kemijskom spoju NaCl također je -1. Budući da ion Na, po definiciji, ima naboj +1, zaključujemo da je naboj iona Cl -1, pa je njegovo oksidacijsko stanje -1.
 3 Imajte na umu da metalni ioni mogu imati nekoliko oksidacijskih stanja. Atomi mnogih metalnih elemenata mogu ionizirati u različitim količinama. Na primjer, ionski naboj metala poput željeza (Fe) iznosi +2 ili +3. Naboj metalnih iona (i njihovo oksidacijsko stanje) može se odrediti nabojima iona drugih elemenata s kojima je ovaj metal dio kemijskog spoja; u tekstu je ovaj naboj označen rimskim brojevima: na primjer, željezo (III) ima oksidacijsko stanje +3.
3 Imajte na umu da metalni ioni mogu imati nekoliko oksidacijskih stanja. Atomi mnogih metalnih elemenata mogu ionizirati u različitim količinama. Na primjer, ionski naboj metala poput željeza (Fe) iznosi +2 ili +3. Naboj metalnih iona (i njihovo oksidacijsko stanje) može se odrediti nabojima iona drugih elemenata s kojima je ovaj metal dio kemijskog spoja; u tekstu je ovaj naboj označen rimskim brojevima: na primjer, željezo (III) ima oksidacijsko stanje +3. - Kao primjer, razmotrimo spoj koji sadrži ion aluminija. Ukupni naboj spoja AlCl3 je nula.Budući da znamo da ioni Cl imaju naboj -1, a spoj sadrži 3 takva iona, za opću neutralnost dotične tvari, ion Al mora imati naboj +3. Dakle, u ovom slučaju oksidacijsko stanje aluminija iznosi +3.
 4 Oksidacijsko stanje kisika je -2 (uz neke iznimke). U gotovo svim slučajevima, atomi kisika imaju oksidacijsko stanje -2. Postoji nekoliko izuzetaka od ovog pravila:
4 Oksidacijsko stanje kisika je -2 (uz neke iznimke). U gotovo svim slučajevima, atomi kisika imaju oksidacijsko stanje -2. Postoji nekoliko izuzetaka od ovog pravila: - Ako je kisik u elementarnom stanju (O2), njegovo oksidacijsko stanje je 0, kao u slučaju ostalih elementarnih tvari.
- Ako je kisik dio peroksid, njegovo oksidacijsko stanje je -1. Peroksidi su skupina spojeva koji sadrže jednostavnu vezu kisik-kisik (tj. Peroksidni anion O2). Na primjer, u sastavu H2O2 (vodikov peroksid) kisik ima naboj i oksidacijsko stanje -1.
- U kombinaciji s fluorom, kisik ima oksidacijsko stanje +2, pročitajte dolje pravilo za fluor.
 5 Vodik ima oksidacijsko stanje +1, uz nekoliko iznimaka. Kao i kod kisika, postoje i iznimke. U pravilu je oksidacijsko stanje vodika +1 (ako nije u elementarnom stanju H2). Međutim, u spojevima koji se nazivaju hidridi, oksidacijsko stanje vodika je -1.
5 Vodik ima oksidacijsko stanje +1, uz nekoliko iznimaka. Kao i kod kisika, postoje i iznimke. U pravilu je oksidacijsko stanje vodika +1 (ako nije u elementarnom stanju H2). Međutim, u spojevima koji se nazivaju hidridi, oksidacijsko stanje vodika je -1. - Na primjer, u H2O Oksidacijsko stanje vodika je +1 jer atom kisika ima naboj -2, a za ukupnu neutralnost potrebna su dva +1 naboja. Ipak, u sastavu natrijevog hidrida oksidacijsko stanje vodika već je -1, budući da ion Na nosi naboj +1, a za opću elektroneutralnost naboj atoma vodika (a time i njegovo oksidacijsko stanje) trebao bi biti -1.
 6 Fluor stalno ima oksidacijsko stanje -1. Kao što je već napomenuto, oksidacijsko stanje nekih elemenata (ioni metala, atomi kisika u peroksidima itd.) Može varirati ovisno o nizu čimbenika. Oksidacijsko stanje fluora je, međutim, uvijek -1. To je zbog činjenice da ovaj element ima najveću elektronegativnost - drugim riječima, atomi fluora najmanje su voljni odvojiti se od vlastitih elektrona i najaktivnije privlače strane elektrone. Stoga njihova optužba ostaje nepromijenjena.
6 Fluor stalno ima oksidacijsko stanje -1. Kao što je već napomenuto, oksidacijsko stanje nekih elemenata (ioni metala, atomi kisika u peroksidima itd.) Može varirati ovisno o nizu čimbenika. Oksidacijsko stanje fluora je, međutim, uvijek -1. To je zbog činjenice da ovaj element ima najveću elektronegativnost - drugim riječima, atomi fluora najmanje su voljni odvojiti se od vlastitih elektrona i najaktivnije privlače strane elektrone. Stoga njihova optužba ostaje nepromijenjena.  7 Zbroj oksidacijskih stanja u spoju jednak je njegovu naboju. Stanja oksidacije svih atoma koji tvore kemijski spoj trebali bi se dodati naboju ovog spoja. Na primjer, ako je spoj neutralan, zbroj oksidacijskih stanja svih njegovih atoma trebao bi biti nula; ako je spoj poliatomski ion s nabojem -1, zbroj oksidacijskih stanja je -1 itd.
7 Zbroj oksidacijskih stanja u spoju jednak je njegovu naboju. Stanja oksidacije svih atoma koji tvore kemijski spoj trebali bi se dodati naboju ovog spoja. Na primjer, ako je spoj neutralan, zbroj oksidacijskih stanja svih njegovih atoma trebao bi biti nula; ako je spoj poliatomski ion s nabojem -1, zbroj oksidacijskih stanja je -1 itd. - Ovo je dobra metoda ispitivanja - ako zbroj oksidacijskih stanja nije jednak ukupnom naboju spoja, negdje griješite.
Dio 2 od 2: Određivanje oksidacijskog stanja bez uporabe zakona kemije
 1 Pronađite atome koji nemaju stroga pravila o svom stanju oksidacije. Za neke elemente ne postoje čvrsto utvrđena pravila za utvrđivanje oksidacijskog stanja. Ako atom ne odgovara niti jednom od gore navedenih pravila, a ne znate njegov naboj (na primjer, atom je dio kompleksa, a naboj nije naveden), možete odrediti oksidacijsko stanje takvog atoma isključenjem. Prvo odredite naboj svih ostalih atoma u spoju, a zatim iz poznatog ukupnog naboja spoja izračunajte oksidacijsko stanje tog atoma.
1 Pronađite atome koji nemaju stroga pravila o svom stanju oksidacije. Za neke elemente ne postoje čvrsto utvrđena pravila za utvrđivanje oksidacijskog stanja. Ako atom ne odgovara niti jednom od gore navedenih pravila, a ne znate njegov naboj (na primjer, atom je dio kompleksa, a naboj nije naveden), možete odrediti oksidacijsko stanje takvog atoma isključenjem. Prvo odredite naboj svih ostalih atoma u spoju, a zatim iz poznatog ukupnog naboja spoja izračunajte oksidacijsko stanje tog atoma. - Na primjer, u spoju Na2TAKO4 naboj atoma sumpora (S) je nepoznat - znamo samo da nije nula, budući da sumpor nije u elementarnom stanju. Ovaj spoj služi kao dobar primjer za ilustraciju algebarske metode za određivanje oksidacijskog stanja.
 2 Pronađi oksidacijska stanja preostalih elemenata u spoju. Koristeći gore opisana pravila, odredite oksidacijska stanja preostalih atoma spoja. Ne zaboravite na iznimke od pravila za O, H itd.
2 Pronađi oksidacijska stanja preostalih elemenata u spoju. Koristeći gore opisana pravila, odredite oksidacijska stanja preostalih atoma spoja. Ne zaboravite na iznimke od pravila za O, H itd. - Za Na2TAKO4, koristeći naša pravila, otkrivamo da je naboj (a time i oksidacijsko stanje) iona Na +1, a za svaki od atoma kisika -2.
 3 Pomnožite broj atoma s oksidacionim stanjem. Sada kada znamo oksidacijska stanja svih atoma osim jednog, potrebno je uzeti u obzir da može postojati nekoliko atoma nekih elemenata. Pomnožite broj atoma svakog elementa (to je naznačeno u kemijskoj formuli spoja kao indeks nakon simbola elementa) njegovim oksidacijskim stanjem.
3 Pomnožite broj atoma s oksidacionim stanjem. Sada kada znamo oksidacijska stanja svih atoma osim jednog, potrebno je uzeti u obzir da može postojati nekoliko atoma nekih elemenata. Pomnožite broj atoma svakog elementa (to je naznačeno u kemijskoj formuli spoja kao indeks nakon simbola elementa) njegovim oksidacijskim stanjem. - U Na2TAKO4 imamo 2 atoma Na i 4 atoma O. Tako množenjem 2 × +1 dobivamo oksidacijsko stanje svih atoma Na (2), a množenjem 4 × -2 -oksidacijsko stanje atoma O (-8).
 4 Zbrojite prethodne rezultate. Zbrajajući rezultate množenja, dobivamo oksidacijsko stanje spoja bez uzimajući u obzir doprinos željenog atoma.
4 Zbrojite prethodne rezultate. Zbrajajući rezultate množenja, dobivamo oksidacijsko stanje spoja bez uzimajući u obzir doprinos željenog atoma. - U našem primjeru, za Na2TAKO4 zbrajamo 2 i -8 i dobivamo -6.
 5 Pronađite nepoznato oksidacijsko stanje iz naboja spoja. Sada imate sve podatke za jednostavno izračunavanje željenog oksidacijskog stanja. Zapišite jednadžbu na čijoj će lijevoj strani biti zbroj broja dobivenog u prethodnom koraku izračuna i nepoznatog oksidacijskog stanja, a na desnoj strani ukupnog naboja spoja. Drugim riječima, (Zbir poznatih oksidacijskih stanja) + (željeno oksidacijsko stanje) = (naboj spoja).
5 Pronađite nepoznato oksidacijsko stanje iz naboja spoja. Sada imate sve podatke za jednostavno izračunavanje željenog oksidacijskog stanja. Zapišite jednadžbu na čijoj će lijevoj strani biti zbroj broja dobivenog u prethodnom koraku izračuna i nepoznatog oksidacijskog stanja, a na desnoj strani ukupnog naboja spoja. Drugim riječima, (Zbir poznatih oksidacijskih stanja) + (željeno oksidacijsko stanje) = (naboj spoja).- U našem slučaju, Na2TAKO4 rješenje izgleda ovako:
- (Zbir poznatih oksidacijskih stanja) + (željeno oksidacijsko stanje) = (složeni naboj)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2TAKO4 sumpor ima oksidacijsko stanje 6.
- U našem slučaju, Na2TAKO4 rješenje izgleda ovako:
Savjeti
- U spojevima zbroj svih oksidacijskih stanja mora biti jednak naboju. Na primjer, ako je spoj dvoatomni ion, zbroj oksidacijskih stanja atoma mora biti jednak ukupnom ionskom naboju.
- Vrlo je korisno znati koristiti periodni sustav i znati gdje se u njemu nalaze metalni i nemetalni elementi.
- Oksidacijsko stanje atoma u elementarnom obliku uvijek je nula. Oksidacijsko stanje jednog iona jednako je naboju. Elementi skupine 1A periodnog sustava, poput vodika, litija, natrija, u elementarnom obliku imaju oksidacijsko stanje +1; Oksidacijsko stanje metala iz skupine 2A, poput magnezija i kalcija, je +2 u elementarnom obliku. Kisik i vodik, ovisno o vrsti kemijske veze, mogu imati 2 različita oksidacijska stanja.
Što trebaš
- Periodni sustav elemenata
- Pristup internetu ili kemijska literatura
- List papira, olovka ili olovka
- Kalkulator