Autor:
John Pratt
Datum Stvaranja:
17 Veljača 2021
Datum Ažuriranja:
26 Lipanj 2024

Sadržaj
- Kročiti
- Metoda 1 od 2: Izračunavanje molarne mase elementa
- Metoda 2 od 2: Izračunavanje molarne mase složene tvari
- Savjeti
- Upozorenja
- Potrebe
Atomi su premali za smislena mjerenja kemikalija. Kako bi mogli raditi s vrlo malim količinama određene tvari, znanstvenici ih klasificiraju u mol. Mol je definiran kao određena količina tvari s onoliko čestica koliko je broj atoma ugljika u 12 grama izotopa C-12, što je približno 6,022 14 × 10. To se naziva Avogadrovim brojem ili konstantom. Koristi se za označavanje broja atoma, molekula, iona ili subatomskih čestica u bilo kojoj tvari, a masa od 1 mola je molarna masa te tvari. Ovdje možete pročitati kako izračunati molarnu masu elemenata i tvari.
Kročiti
Metoda 1 od 2: Izračunavanje molarne mase elementa
 Pronađite relativnu atomsku masu elementa. Relativna atomska masa elementa ponderirani je prosjek, izražen u jedinicama atomske mase (u), atomskih masa svih prirodnih izotopa. Te se informacije mogu naći u periodnom sustavu. Kao primjer, vodik ima relativnu atomsku masu 1,008; ugljik 12,0107; kisik 15.9994; i klora 35.453.
Pronađite relativnu atomsku masu elementa. Relativna atomska masa elementa ponderirani je prosjek, izražen u jedinicama atomske mase (u), atomskih masa svih prirodnih izotopa. Te se informacije mogu naći u periodnom sustavu. Kao primjer, vodik ima relativnu atomsku masu 1,008; ugljik 12,0107; kisik 15.9994; i klora 35.453. 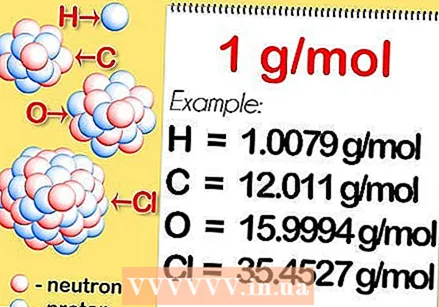 Pomnožite s molarnom masom. To se definira kao 1 gram po molu. To pretvara jedinicu atomske mase u grame po molu, čineći molarnu masu vodika jednakom 1.008 grama po molu, ugljika 12.0107 grama po molu, kisika 15.9994 grama po molu i klora 35.453 grama po molu.
Pomnožite s molarnom masom. To se definira kao 1 gram po molu. To pretvara jedinicu atomske mase u grame po molu, čineći molarnu masu vodika jednakom 1.008 grama po molu, ugljika 12.0107 grama po molu, kisika 15.9994 grama po molu i klora 35.453 grama po molu. - Pronađite molarnu masu dvovalentne molekule. Neki se elementi mogu naći samo u molekulama od 2 ili više. To znači da ako želite izračunati molarnu masu elementa koji se, na primjer, sastoji od 2 atoma, poput vodika, kisika i klora, odredite relativnu atomsku masu i pomnožite je s molarnom masom te pomnožite rezultat 2.
- Molarna masa elementa tada je jednaka molarnoj masi jednog atoma pomnoženoj s brojem atoma u svakoj molekuli: u slučaju vodika 1,008 puta 2 ili 2,016 grama po molu; kisik, 15,9994 puta 2 ili 31,9988 grama po molu; i s klorom, 35,453 puta 2, ili 70,096 grama po molu.
Metoda 2 od 2: Izračunavanje molarne mase složene tvari
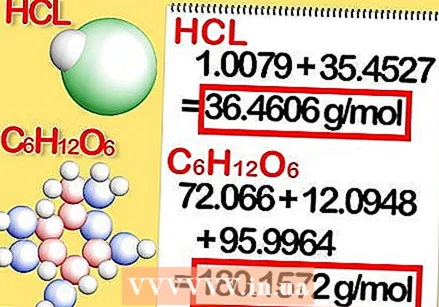
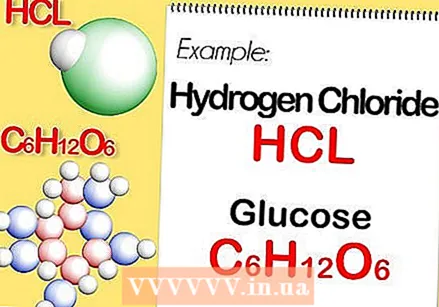 Odrediti kemijsku formulu spoja. Ovo je broj atoma u svakom elementu spoja. (O tome ćete pronaći podatke, na primjer, u Binasu) Na primjer: formula za klorovodik (klorovodična kiselina) je HCl; za glukozu C6H.12O6. Posljednja formula znači da glukoza sadrži 6 atoma ugljika, 12 atoma vodika i 6 atoma kisika.
Odrediti kemijsku formulu spoja. Ovo je broj atoma u svakom elementu spoja. (O tome ćete pronaći podatke, na primjer, u Binasu) Na primjer: formula za klorovodik (klorovodična kiselina) je HCl; za glukozu C6H.12O6. Posljednja formula znači da glukoza sadrži 6 atoma ugljika, 12 atoma vodika i 6 atoma kisika. 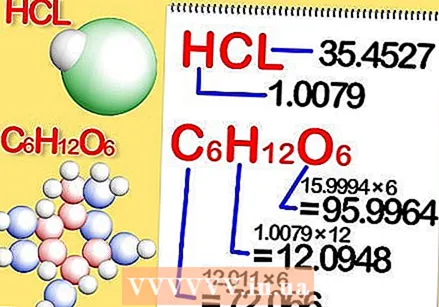 Odredite molarnu masu svakog elementa u spoju. Pomnožite atomsku masu elementa s molarnom masom i brojem atoma elementa u spoju. Evo kako to funkcionira:
Odredite molarnu masu svakog elementa u spoju. Pomnožite atomsku masu elementa s molarnom masom i brojem atoma elementa u spoju. Evo kako to funkcionira: - Molarna masa svakog elementa klorovodika, HCl, iznosi 1.008 grama po molu vodika i 35.453 grama po molu klora.
- Molarna masa svakog elementa glukoze, C.6H.12O6, je 12,0107 puta 6, ili 72,0642 grama po molu ugljika; 1.008 puta 12, ili 12.096 grama po molu vodika; i 15,9994 puta 6, ili 95,9964 grama po molu kisika.
 Dodajte molarne mase svakog elementa u spoju. To daje molarnu masu spoja. Evo kako:
Dodajte molarne mase svakog elementa u spoju. To daje molarnu masu spoja. Evo kako: - Molarna masa klorovodika je 1,008 + 35,453 ili 36,461 grama po molu.
- Molarna masa glukoze je 72,0642 + 12,096 + 95,9964, ili 180,1566 grama po molu.
Savjeti
- Iako u većini slučajeva relativne atomske mase imaju točnost od 4 decimale, u laboratoriju se točnost od 2 decimale ili manje odnosi na iznimno velike mase. Dakle, u laboratoriju je molarna masa klorovodika 36,46 grama po molu, a glukoze 180,16 grama po molu.
Upozorenja
- Nemojte brkati molarnu masu i molekularnu masu. Potonja je masa pojedine molekule elementa ili spoja. Molarna masa može se shvatiti kao prosječna masa svih molekula u uzorku određene tvari, kao što je relativna atomska masa prosjek atomskih masa svih izotopa.
Potrebe
- Bine i periodni sustav elemenata
- Kalkulator